Ley de Boyle :Presión vs Volumen (Fiz109 DS)
Contents |
Presión vs Volumen
Objetivo
Determinar experimentalmente la relación existente entre la presión y el volumen de aire a temperatura constante.
Materiales
- Sensor de Presión
- Jeringa
- Computador PC con interfaz Pasco
- Programa DATA STUDIO
Teoría
Para describir el comportamiento de un gas necesitamos cuatro cantidades medibles; la presión, el volumen, el número de moléculas o su equivalente en moles y la temperatura. Juntas esas cantidades determinan el estado de una muestra de gas. Roberto Boyle (1627-1691) estudió los cambios en el volumen de un gas así como la presión variaba. Realizando el experimento bajo condiciones controladas, él mantuvo la masa y la temperatura del gas constantes. Luego bajo tales circunstancias la relación entre la presión y el volumen
, conocida como la Ley de Boyle se expresó de la siguiente manera:
Con
En otras palabras la presión de un número constante de moléculas dada de un gas ideal es inversamente proporcional al volumen si la temperatura permanece constante.
Montaje Experimental
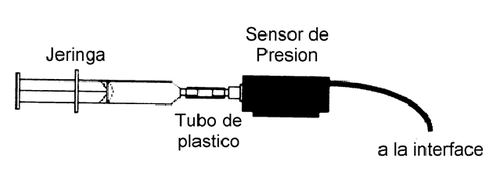
- Arme el sistema de la figura 1, conectando el sensor de presión a la jeringa
- Conecte el sensor de presión al canal análogo A .
Procedimiento
- 1) Ponga en ejecución el programa Data Studio. Aparecerá en la pantalla la ventana para comenzar el experimento .
- 2) Arrastre el icono que representa el sensor análogo al canal A .Escoja en la lista de sensores , Pressure Sensor Absolute (Sensor de Presion Absoluta), que corresponde al sensor de presión.
- 3) Presione Options (opciones) y active la opción relacionada al teclado Keyboard, para ingresar datos por el teclado. Ingrese volumen en el casillero de Name y cc en Units. Presione OK.
- 4) Presione el botón
 Calculate (calculadora) para ingresar la fórmula para calcular el inverso del volumen. Para ello define la variable
Calculate (calculadora) para ingresar la fórmula para calcular el inverso del volumen. Para ello define la variable , donde la variable
la tiene que definir como volume(volumen). Presione aceptar
- 5) Ubique el pistón en la posición
de la graduación de la jeringa. Antes de iniciar la recolección de datos, desplace el pistón lentamente hasta la posición
.
- 6) Para iniciar la recolección de datos presione START (Inicio) y luego Keep (Mantener) en ese instante se abrirá una ventana e ingrese el primer dato de volumen,
., y así comience a ingresar de a
sucesivamente hasta llegar a tener unos 10 pares de datos medidos.. Al finalizar presione el botón rojo
 .
.
| NOTA: Debe desplazar cuasiestáticamente (muy lentamente) el pistón de la jeringa y espere unos 5 segundos antes de desplazar a la otra unidad de volumen, ya que podría afectar las condiciones de estabilidad del sistema . |
| PRECAUCIÓN: A Lo más probable que al bajar de los |
Análisis
- 1) Obtenga el gráfico
versus
. ¿Qué representa físicamente la curva de éste?. Explique
- 2) Obtenga el área bajo la curva del gráfico
versus
. Interprete físicamente el resultado. Explique.(Para obtener el área bajo la curva presione
 , y seleccione Area)
, y seleccione Area)
- 3) Obtenga el gráfico
versus
(involumen). Obtenga el valor de la pendiente de la curva graficada. Interprete físicamente este resultado.
- 4) Obtenga el número de moles del aire encerrado en el cilindro, a partir del área del gráfico
versus
, calculada en el punto (2).(Recuerde que el trabajo realizado por el pistón está dado por :
- 5) Calcule el número de moles a partir de la pendiente del gráfico
versus
.
- 6) Compare ambos resultados.
- 7) Obtener la masa del gas encerrado, en gramos, a partir de los resultados anteriores obtenidos.
- 8) El proceso realizado ¿es un trabajo positivo o negativo?. Justifique.