Determinación de la Constante de Planck por el Efecto Fotoeléctrico (Fiz0311)
Contents |
Determinación de la Constante de Planck por el Efecto Fotoeléctrico
Objetivo
Estimación del valor de la Constante de Planck mediante un tubo foteléctrico
Equipamiento
- Tubo fotoeléctrico
- Convertidor Voltaje-Corriente
- Microamperímetro
- Multitester
- Lámpara de Mercurio
- Filtros ópticos
- Láser
Observaciones Experimentales
- Se observa que cuando luz visible o ultravioleta se hace incidir sobre ciertos metales, se produce una emisión de electrones (emisión fotoelectrónica).
- La emisión de electrones no es observada para ciertas frecuencias (independiente de la intensidad de la luz) por debajo de la frecuencia crítica o también denominada frecuencia umbral.
- Al aumentar la intensidad del haz de luz, a una frecuencia que produzca emisión electrónica (por sobre la frecuencia umbral), se observa mayor emisión electrónica.
- La emisión de electrones es casi espontánea.
Teoría
La teoría clásica electromagnética no era capaz de explicar el efecto fotoeléctrico. Fue Einstein (1905) quien propuso la teoría corpuscular de la luz. Es decir, la luz está formada por partículas, llamadas fotones, cuya energía de cada fotón es
De esta manera, los electrones al estar ligados al metal con cierta energía (función trabajo), podrán ser liberados siempre y cuando la energía del fotón incidente sea mayor que la función trabajo. Así, se produce una especie de aniquilación del fotón, entregando el remanente de energía al electrón (energía cinética). Por conservación de energía tendremos
Entonces, es posible extraer un electrón del metal, si y sólo si, la energía del fotón supera la función trabajo, independiente de la intensidad de la luz (fotones por unidad de tiempo y unidad de área).
Al superar la energía del fotón a la función trabajo, tendremos que, al aumentar la intensidad de la luz más electrones serán emitidos, con cierta energía cinética dada por (2). Es así que la teoría cuántica de la luz describe completamente el efecto fotoeléctrico.
Nuestro experimento
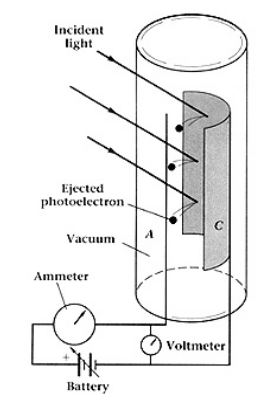
La figura (1) muestra un esquema del montaje experimental. La luz al incidir sobre la celda fotoeléctrica (cátodo) provoca una emisión de electrones, estos, al tener una cierta energía cinética alcanzaran el ánodo generando una corriente en el circuito.
Sin embargo, podemos aplicar una cierta diferencia de potencial entre el ánodo-cátodo para poder determinar la energía cinética de los electrones. Si este voltaje (diferencia de potencial) lo aumentamos hasta el punto en que no vemos corriente en el circuito, podemos decir que el voltaje repele completamente a los electrones, y por lo tanto:
Y así, hemos determinado la energía cinética de los electrones. Si reemplazamos (3) en (2) obtenemos,
O, reagrupando términos,
De esta forma, podemos ver de la ecuación (5) que la constante de Plank es la pendiente de la recta versus
.
Montaje Experimental
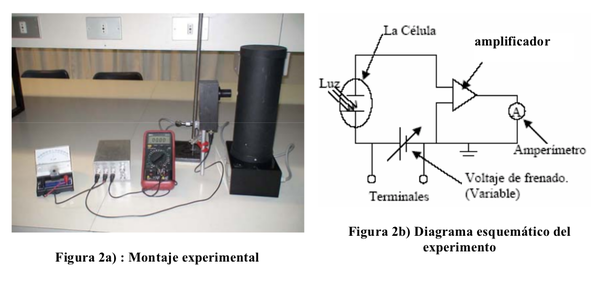
La figura 2a) muestra una foto del montaje del equipo de este experimento. La figura 2b) muestra un diagrama esquemático de circuito experimental. El amplificador se utiliza para poder amplificar la corriente generada por el efecto fotoeléctrico, y poder medirla con el amperímetro.
El tubo fotoeléctrico consiste en dos electrodos (ánodo y cátodo) en un ambiente a muy baja presión. La incidencia de los fotones en el cátodo libera electrones por el efecto fotoeléctrico, el tubo al estar a muy baja presión ayuda que los electrones alcancen el ánodo. Estos electrones tienen una energía cinética, dada por la ec (2) y por lo tanto se genera una corriente. Esta corriente es casi indetectable y por lo tanto necesitamos un amplificador.
Se usa una lámpara de mercurio como fuente de luz. La luz emitida por la lámpara consiste en varias líneas de transición electrónica de los átomos de mercurio, por ejemplo ver http://physics.nist.gov/PhysRefData/ASD/lines_form.html para generar un espectro sintético. A la lámpara de mercurio es posible acoplar distintos filtros, los cuales tienen una cierta banda de transmisión (sólo se transmite un rango pequeño de longitudes de onda, en torno de un valor nominal), con los cuales es posible seleccionar una determinada longitud de onda del espectro de la lámpara de mercurio.
Entonces, de ésta forma se puede escoger la longitud de onda incidente en el cátodo a través del filtro seleccionado (la idea es conocer la frecuencia del fotón incidente).
Procedimiento
- 1.- Monte la lámpara de Mercurio cerca de la apertura de la Célula Fotoeléctrica. Una vez encendida, no apagar la lámpara hasta el fin de experimento.
- 2.- Encienda la lámpara y ubique en el portafiltros un filtro que dejará pasar un haz de longitud de onda conocido.
- 3.- Observe la deflexión de la aguja en el amperímetro y midiéndolo comience a aumentar el voltaje de frenado hasta que la corriente sea nula. Anote el valor del potencial aplicado y la longitud de onda del haz incidente.
- 4.- Repita el paso 3 variando la longitud de onda del haz incidente.
- 5.- Repita el paso 3 usando el Láser como fuente de luz monocromática. Use una lente para expandir el haz del Láser para que ilumine una área más grande del cátodo.
Análisis
- a) Realice un gráfico Voltaje de frenado versus
.
- b) Por un método gráfico y utilizando la ecuación (4), obtenga un valor para la constante de Planck. (Recuerde que hay que contar el error en la medición)
- c) Interprete el valor del intercepto de la curva con el Eje
. (Extrapole la curva si es necesario).
Preguntas
- ¿La corriente fotoeléctrica varía con la intensidad luminosa?. ¿Concuerda esto con la teoría de las ondas de luz?. Explique
- ¿El potencial de frenado varía con la intensidad luminosa? ¿Concuerda esto con la teoría de las ondas de luz?. Explique
- Si en vez de hacer incidir un haz luminoso en el metal, éste se bombardeara con partículas de alta energía, ¿se produciría la emisión de electrones? Explique su respuesta.
- ¿Es necesario usar ecuaciones relativistas para calcular la energía de los electrones? Explique su respuesta.
- De algunas sugerencias para reducir el error experimental en la determinación de la constante de Planck.