Experimento Calor Específico
| Line 100: | Line 100: | ||
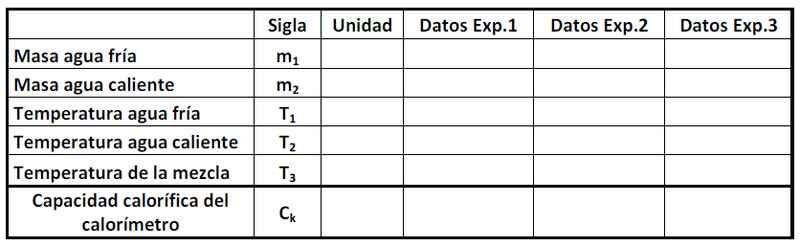
| − | : 1. Añada al calorímetro <m>100 ml</m> de agua a temperatura ambiente previamente pesada. Observe la lectura del termómetro y cuando esta |
+ | : 1. Mase el calorímetro. |
| − | se estabilice, registre su valor como <m>T_1</m> (Temperatura inicial sistema calorímetro más agua) en la tabla que se muestra más adelante. |
||
| − | : 2. Caliente en un vaso precipitado <m>100 ml</m> de agua a una temperatura aproximada de 50°C y registre esta temperatura como <m>T_2</m>. Vierta esta cantidad de agua caliente (previamente pesada) en el calorímetro con agua y ciérrelo. Homogenice la temperatura del agua agitando suavemente el calorímetro. Espere unos segundos hasta que la temperatura llegue a un valor estacionario y registre esta temperatura como <m>T_3</m>. |
+ | : 2. Añada al calorímetro <m>100 ml</m> de agua a temperatura ambiente previamente pesada. Observe el termómetro y registre su valor cuando se estabilice (variación de menos de 1 grado). |
| − | : 3. Luego de anotar los datos en la tabla, determine la capacidad calorífica del calorímetro (<m>C_k</m>) aplicando la ley de la conservación de la energía. |
+ | : 2. Mase <m>300 ml</m> de agua en un vaso precipitado y luego caliéntela a una temperatura aproximada de 60°C. Mida su temperatura y viértala en el calorímetro. |
| + | |||
| + | : 3. Cierre el calorímetro y mantenga el termómetro estático todo el tiempo. En una tabla registre la temperatura de la mezcla en función del tiempo cada 5 segundos hasta que la temperatura se estabilice (variación de menos de 1 grado). |
||
| + | |||
| + | : 4. Grafique los datos de temperatura en función del tiempo. Determine la capacidad calorífica del calorímetro (<m>C_k</m>) aplicando la ley de la conservación de la energía. |
||
: . Realice el experimento anterior 5 veces. |
: . Realice el experimento anterior 5 veces. |
||
| Line 126: | Line 126: | ||
==== Análisis de Resultados==== |
==== Análisis de Resultados==== |
||
| − | 1) ¿Cuál es el valor experimental encontrado por su grupo para la capacidad calórica del calorímetro <m>C_k</m>? ¿Cómo se compara por el encontrado por otros grupos? |
+ | 1) ¿Qué tipo de curva se observa para la temperatura de la mezcla en función del tiempo? ¿Cómo se relaciona esta curva con la Ley de enfriamiento de Newton? |
| + | |||
| + | 2) ¿Cuál es el valor experimental encontrado por su grupo para la capacidad calórica del calorímetro <m>C_k</m>? ¿Cómo se compara por el encontrado por otros grupos? |
||
| − | 2) ¿Cuál es el valor experimental reportado por su grupo para el calor específico del calorímetro de acero? ¿Cómo se compara con valores reportados por fuentes reconocidas internacionalmente? |
+ | 3) ¿Cuál es el valor experimental reportado por su grupo para el calor específico del calorímetro de acero? ¿Cómo se compara con valores reportados por fuentes reconocidas internacionalmente? |
| − | 3) ¿Cómo se compara el valor del error con el valor de la medida del calor específico? ¿Cuáles son las posibles fuentes de error en la determinación del calor específico del acero del calorímetro? |
+ | 4) ¿Cómo se compara el valor del error con el valor de la medida del calor específico? ¿Cuáles son las posibles fuentes de error en la determinación del calor específico del acero del calorímetro? |
| − | 4) ¿Cuál es el valor experimental reportado por su grupo para el calor específico del cobre <m>c_{Cu}</m>? ¿Qué aspectos del procedimiento experimental podrían ser mejorados para obtener un valor del calor específico del metal con un menor porcentaje de error? |
+ | 5) ¿Cuál es el valor experimental reportado por su grupo para el calor específico del cobre <m>c_{Cu}</m>? ¿Qué aspectos del procedimiento experimental podrían ser mejorados para obtener un valor del calor específico del metal con un menor porcentaje de error? |
Revision as of 09:43, 6 November 2015
Contents |
Calor Expecífico
Objetivos
- Comprobar experimentalmente la relación entre el calor y la temperatura.
- Determinar el calor específico de un metal.
Introducción
Diferentes sustancias requieren diferentes cantidades de calor para producir un cambio dado en su temperatura. Por ejemplo, para incrementar la
temperatura de de agua en una cantidad
de temperatura se requiere alrededor de 10 veces más calor que para incrementar en esta misma cantidad
la temperatura de
de cobre. Este comportamiento de los materiales es caracterizado cuantitativamente por el calor específico, que es la cantidad de calor necesaria para incrementar la temperatura de
de sustancia en 1°C. Así, el agua tiene un calor específico de mayor valor que el cobre.
El calor específico de un material es característico para cada sustancia y depende de su estructura interna. Como puede ser visto de la definición, el calor específico de una sustancia dada puede ser determinado mediante la entrega de una cantidad de calor conocida a una cantidad de masa determinada de la sustancia y con un apropiado registro del cambio en su temperatura. El propósito de este experimento es determinar el calor específico de un material en particular mediante los métodos de calorimetría.
Teoría
Una variación en la temperatura de una sustancia es proporcional a la cantidad de calor
que se agrega o extrae de esta, o sea:
Escrito en forma de ecuación
Donde la constante de proporcionalidad es llamada capacidad calorífica de la sustancia.
Sin embargo la cantidad de calor requerido para cambiar la temperatura de un objeto es también proporcional a la masa de este, por lo tanto es
conveniente definir la cantidad llamada capacidad calorífica específica (o calor específico)
que es la capacidad calorífica por unidad de masa de la sustancia. Así, la ecuación (1) puede ser escrita como:
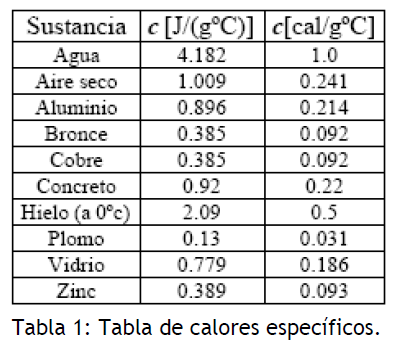
Donde el calor específico es la cantidad de calor (en calorías) necesaria para incrementar la temperatura de 1 gramo de sustancia en 1 grado Celsius.
De hecho, la caloría es la unidad de calor definida como la cantidad de calor requerido para incrementar la temperatura de de agua en 1°C. Por definición, el agua tiene un calor específico de
.
En la tabla mostrada a continuación se presentan los valores de los calores específicos para algunos materiales.
El calor específico de un material puede ser determinado experimentalmente midiendo el cambio de temperatura que presenta una determinada masa del material al entregarle una cierta cantidad de calor. Esto puede ser realizado indirectamente por un procedimiento de calorimetría conocido como el método de mezclas. Varias sustancias a diferentes temperaturas se ponen en contacto térmico, las sustancias calientes entregan calor a las sustancias frías hasta que todas las sustancias alcanzan una temperatura de equilibrio común.
Si el sistema está aislado de manera que no pueda intercambiar calor con sus alrededores, por conservación de energía, la cantidad de calor que pierden las sustancias calientes es la misma que ganan las sustancias frías.
En este experimento, agua caliente es añadida a un calorímetro de acero hasta que el sistema alcanza el equilibrio térmico. Note que el calorímetro tiene la función de aislar su interior para evitar el flujo de calor.
Métodos Experimentales
Equipamiento Requerido:
- 1 calorímetro
- 1 termómetro de mercurio
- 1 vaso precipitado de
- 1 calentador eléctrico de
- 1 guante térmico
- Balanza
PRECAUCIÓN
La superficie del calentador puede llegar a temperaturas cercanas a los 350 °C, por ello debe tener mucha precaución al manipular este calentador.
Recuerde utilizar siempre el guante térmico para manipular el vaso precipitado cuando esté a una temperatura elevada.
Procedimiento Experimental
- 1. Mase el calorímetro.
- 2. Añada al calorímetro
de agua a temperatura ambiente previamente pesada. Observe el termómetro y registre su valor cuando se estabilice (variación de menos de 1 grado).
- 2. Mase
de agua en un vaso precipitado y luego caliéntela a una temperatura aproximada de 60°C. Mida su temperatura y viértala en el calorímetro.
- 3. Cierre el calorímetro y mantenga el termómetro estático todo el tiempo. En una tabla registre la temperatura de la mezcla en función del tiempo cada 5 segundos hasta que la temperatura se estabilice (variación de menos de 1 grado).
- 4. Grafique los datos de temperatura en función del tiempo. Determine la capacidad calorífica del calorímetro (
) aplicando la ley de la conservación de la energía.
- . Realice el experimento anterior 5 veces.
- Si el valor de
no tiene una dispersión excesiva, promedie los valores y anote como error la desviación estándar. En caso contrario repita sus medidas con cuidado y estudie donde puede estar el problema.
Nota: El valor experimental de debe ser reportado como:
La desviación estándar () está dada por:
Donde es el número de mediciones,
la medición i-ésima y
es el promedio de las
mediciones.
Análisis de Resultados
1) ¿Qué tipo de curva se observa para la temperatura de la mezcla en función del tiempo? ¿Cómo se relaciona esta curva con la Ley de enfriamiento de Newton?
2) ¿Cuál es el valor experimental encontrado por su grupo para la capacidad calórica del calorímetro ? ¿Cómo se compara por el encontrado por otros grupos?
3) ¿Cuál es el valor experimental reportado por su grupo para el calor específico del calorímetro de acero? ¿Cómo se compara con valores reportados por fuentes reconocidas internacionalmente?
4) ¿Cómo se compara el valor del error con el valor de la medida del calor específico? ¿Cuáles son las posibles fuentes de error en la determinación del calor específico del acero del calorímetro?
5) ¿Cuál es el valor experimental reportado por su grupo para el calor específico del cobre ? ¿Qué aspectos del procedimiento experimental podrían ser mejorados para obtener un valor del calor específico del metal con un menor porcentaje de error?