Experimento Calor Específico
| (6 intermediate revisions by one user not shown) | |||
| Line 5: | Line 5: | ||
- Comprobar experimentalmente la relación entre el calor y la temperatura. |
- Comprobar experimentalmente la relación entre el calor y la temperatura. |
||
| − | - Determinar el calor específico de un metal. |
+ | - Determinar el calor específico de un calorímetro metálico. |
| Line 72: | Line 72: | ||
<u>Equipamiento Requerido:</u> |
<u>Equipamiento Requerido:</u> |
||
| − | - 1 calorímetro |
+ | - 1 calorímetro metálico |
- 1 termómetro de mercurio |
- 1 termómetro de mercurio |
||
| Line 100: | Line 100: | ||
| − | : 1. Mase el calorímetro de metal sin tapa. Luego tápelo, introduzca el termómetro y mida la temperatura una vez que se estabilice (variación de menos de 1 grado). |
+ | : 1. Mase el calorímetro metálico sin tapa. Luego tápelo, introduzca el termómetro y mida la temperatura dentro del calorímetro una vez que se estabilice (variación de menos de 1 grado). |
| − | : 2. Mase <m>300 ml</m> de agua en un vaso precipitado y luego caliéntela a una temperatura aproximada de 60°C. Mida su temperatura una vez que se estabilice (variación de menos de 1 grado) y viértala en el calorímetro. |
+ | : 2. Mase <m>300 ml</m> de agua en un vaso precipitado y luego caliéntela a una temperatura aproximada de 60°C. |
| − | : 3. Cierre el calorímetro, introduzca el termómetro estático todo el tiempo. En una tabla registre la temperatura de la mezcla en función del tiempo cada 3 segundos hasta que la temperatura se estabilice (variación de menos de 1 grado). |
+ | : 3. Mida la temperatura del agua e inmediatamente viértala en el calorímetro. Rápidamente cierre el calorímetro e introduzca el termómetro. |
| + | |||
| + | : 4. En una tabla registre la temperatura en función del tiempo cada 3 segundos hasta que la temperatura se estabilice (variación de menos de 1 grado). Procure no mover el termómetro durante el registro de datos. |
||
: 4. Grafique los datos de temperatura en función del tiempo. |
: 4. Grafique los datos de temperatura en función del tiempo. |
||
| Line 110: | Line 110: | ||
: 5. Determine la capacidad calorífica y el calor específico del del calorímetro. |
: 5. Determine la capacidad calorífica y el calor específico del del calorímetro. |
||
| − | : 6. Realice el mismo experimento 3 veces y calcule un valor promedio y un error para el valor del calor específico. |
+ | : 6. Repita 5 veces el procedimiento 3 registrando solo las temperaturas inicial y final. Luego exprese un valor experimental(*) para el calor específico del metal del calorímetro. |
| − | + | (*) '''Nota:''' El valor experimental de <m>C_k</m> debe ser reportado como: |
|
| − | '''Nota:''' El valor experimental de <m>C_k</m> debe ser reportado como: |
||
:<center><m>C_k=\bar{x} \pm \sigma</m></center> |
:<center><m>C_k=\bar{x} \pm \sigma</m></center> |
||
| − | + | Donde <m>\bar{x}</m> es el promedio simple de <m>N</m> mediciones y la desviación estándar (<m>\sigma</m>) está dada por: |
|
| − | La desviación estándar (<m>/sigma</m>) está dada por: |
||
:<center><m>\sigma=\sqrt{\frac{1}{N}\sum_{i=1}^N(x_i-\bar{x})^2}</m></center> |
:<center><m>\sigma=\sqrt{\frac{1}{N}\sum_{i=1}^N(x_i-\bar{x})^2}</m></center> |
||
| − | Donde <m>N</m> es el número de mediciones, <m>x_i</m> la medición i-ésima y <m>\bar{x}</m> es el promedio de las <m>N</m> mediciones. |
+ | Donde <m>x_i</m> corresponde a la la medición i-ésima. |
| Line 127: | Line 127: | ||
1) ¿Qué tipo de curva se observa para la temperatura de la mezcla en función del tiempo? ¿Cómo se relaciona esta curva con la Ley de enfriamiento de Newton? |
1) ¿Qué tipo de curva se observa para la temperatura de la mezcla en función del tiempo? ¿Cómo se relaciona esta curva con la Ley de enfriamiento de Newton? |
||
| − | 2) ¿Cuál es el valor experimental encontrado por su grupo para la capacidad calórica del calorímetro <m>C_k</m>? ¿Cómo se compara por el encontrado por otros grupos? |
+ | 2) ¿Cuál es el valor experimental de la capacidad calórica del calorímetro metálico <m>C_k</m>? ¿Cómo se compara este con valores encontrados por otros grupos? |
| − | |||
| − | 3) ¿Cuál es el valor experimental reportado por su grupo para el calor específico del calorímetro de acero? ¿Cómo se compara con valores reportados por fuentes reconocidas internacionalmente? |
||
| − | 4) ¿Cómo se compara el valor del error con el valor de la medida del calor específico? ¿Cuáles son las posibles fuentes de error en la determinación del calor específico del acero del calorímetro? |
+ | 3) ¿Cuál es el valor experimental del calor específico del calorímetro metálico? ¿A qué metal podría corresponder este valor de calor específico? |
| − | 5) ¿Cuál es el valor experimental reportado por su grupo para el calor específico del cobre <m>c_{Cu}</m>? ¿Qué aspectos del procedimiento experimental podrían ser mejorados para obtener un valor del calor específico del metal con un menor porcentaje de error? |
+ | 4) ¿Cuáles son las posibles fuentes de error en la determinación del calor específico del metal del calorímetro? ¿Qué aspectos del procedimiento experimental podrían ser mejorados para reducir este error? |
Latest revision as of 09:54, 6 November 2015
Contents |
[edit] Calor Expecífico
[edit] Objetivos
- Comprobar experimentalmente la relación entre el calor y la temperatura.
- Determinar el calor específico de un calorímetro metálico.
[edit] Introducción
Diferentes sustancias requieren diferentes cantidades de calor para producir un cambio dado en su temperatura. Por ejemplo, para incrementar la
temperatura de de agua en una cantidad
de temperatura se requiere alrededor de 10 veces más calor que para incrementar en esta misma cantidad
la temperatura de
de cobre. Este comportamiento de los materiales es caracterizado cuantitativamente por el calor específico, que es la cantidad de calor necesaria para incrementar la temperatura de
de sustancia en 1°C. Así, el agua tiene un calor específico de mayor valor que el cobre.
El calor específico de un material es característico para cada sustancia y depende de su estructura interna. Como puede ser visto de la definición, el calor específico de una sustancia dada puede ser determinado mediante la entrega de una cantidad de calor conocida a una cantidad de masa determinada de la sustancia y con un apropiado registro del cambio en su temperatura. El propósito de este experimento es determinar el calor específico de un material en particular mediante los métodos de calorimetría.
[edit] Teoría
Una variación en la temperatura de una sustancia es proporcional a la cantidad de calor
que se agrega o extrae de esta, o sea:
Escrito en forma de ecuación
Donde la constante de proporcionalidad es llamada capacidad calorífica de la sustancia.
Sin embargo la cantidad de calor requerido para cambiar la temperatura de un objeto es también proporcional a la masa de este, por lo tanto es
conveniente definir la cantidad llamada capacidad calorífica específica (o calor específico)
que es la capacidad calorífica por unidad de masa de la sustancia. Así, la ecuación (1) puede ser escrita como:
Donde el calor específico es la cantidad de calor (en calorías) necesaria para incrementar la temperatura de 1 gramo de sustancia en 1 grado Celsius.
De hecho, la caloría es la unidad de calor definida como la cantidad de calor requerido para incrementar la temperatura de de agua en 1°C. Por definición, el agua tiene un calor específico de
.
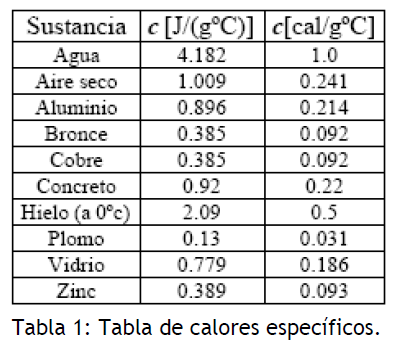
En la tabla mostrada a continuación se presentan los valores de los calores específicos para algunos materiales.
El calor específico de un material puede ser determinado experimentalmente midiendo el cambio de temperatura que presenta una determinada masa del material al entregarle una cierta cantidad de calor. Esto puede ser realizado indirectamente por un procedimiento de calorimetría conocido como el método de mezclas. Varias sustancias a diferentes temperaturas se ponen en contacto térmico, las sustancias calientes entregan calor a las sustancias frías hasta que todas las sustancias alcanzan una temperatura de equilibrio común.
Si el sistema está aislado de manera que no pueda intercambiar calor con sus alrededores, por conservación de energía, la cantidad de calor que pierden las sustancias calientes es la misma que ganan las sustancias frías.
En este experimento, agua caliente es añadida a un calorímetro de acero hasta que el sistema alcanza el equilibrio térmico. Note que el calorímetro tiene la función de aislar su interior para evitar el flujo de calor.
[edit] Métodos Experimentales
Equipamiento Requerido:
- 1 calorímetro metálico
- 1 termómetro de mercurio
- 1 vaso precipitado de
- 1 calentador eléctrico de
- 1 guante térmico
- Balanza
PRECAUCIÓN
La superficie del calentador puede llegar a temperaturas cercanas a los 350 °C, por ello debe tener mucha precaución al manipular este calentador.
Recuerde utilizar siempre el guante térmico para manipular el vaso precipitado cuando esté a una temperatura elevada.
Procedimiento Experimental
- 1. Mase el calorímetro metálico sin tapa. Luego tápelo, introduzca el termómetro y mida la temperatura dentro del calorímetro una vez que se estabilice (variación de menos de 1 grado).
- 2. Mase
de agua en un vaso precipitado y luego caliéntela a una temperatura aproximada de 60°C.
- 3. Mida la temperatura del agua e inmediatamente viértala en el calorímetro. Rápidamente cierre el calorímetro e introduzca el termómetro.
- 4. En una tabla registre la temperatura en función del tiempo cada 3 segundos hasta que la temperatura se estabilice (variación de menos de 1 grado). Procure no mover el termómetro durante el registro de datos.
- 4. Grafique los datos de temperatura en función del tiempo.
- 5. Determine la capacidad calorífica y el calor específico del del calorímetro.
- 6. Repita 5 veces el procedimiento 3 registrando solo las temperaturas inicial y final. Luego exprese un valor experimental(*) para el calor específico del metal del calorímetro.
(*) Nota: El valor experimental de debe ser reportado como:
Donde es el promedio simple de
mediciones y la desviación estándar (
) está dada por:
Donde corresponde a la la medición i-ésima.
[edit] Análisis de Resultados
1) ¿Qué tipo de curva se observa para la temperatura de la mezcla en función del tiempo? ¿Cómo se relaciona esta curva con la Ley de enfriamiento de Newton?
2) ¿Cuál es el valor experimental de la capacidad calórica del calorímetro metálico ? ¿Cómo se compara este con valores encontrados por otros grupos?
3) ¿Cuál es el valor experimental del calor específico del calorímetro metálico? ¿A qué metal podría corresponder este valor de calor específico?
4) ¿Cuáles son las posibles fuentes de error en la determinación del calor específico del metal del calorímetro? ¿Qué aspectos del procedimiento experimental podrían ser mejorados para reducir este error?